Теплота в молекулярной физике
Теплота в молекулярной физике
- Теплообмен и теплота
- Понятия, связанные с процессом теплообмена
Данный раздел молекулярной физики описывает вопросы структуры и свойств вещества на основе их молекулярно-кинетических особенностей. Основными представлениями, на которых основаны все законы данного раздела, являются следующие:
- состав всех физических веществ представлен молекулами, атомами и ионами, которые также имеют сложное строение;
- молекулы, атомы и ионы обладают непрерывным тепловым движением, причем скорость их движения напрямую зависит от их температуры;
- атомы и молекулы взаимно притягиваются и отталкиваются, что вызвано действием определенных сил.
Самым важным свойством веществ данной системы является теплота. В термодинамике теплота является энергией движения молекул.
На изменение теплоты влияют два фактора: внешнее воздействие на систему и теплообмен системы с внешней средой. Для второго случая характерно понятие количества теплоты.
Единицей измерения количества теплоты является джоуль (Дж). Один джоуль — это количество энергии, которая затрачивается при перемещении на 1 метр в сторону действия силы в 1 Ньютон. То есть, \(1Дж=1Н*1м=1кг*1м^2*1с^2.\)
Еще одной единицей измерения теплоты является калория. Одной калории равна энергия, которую затратили при нагревании на 1 градус Цельсия 1 грамма воды.
Теплообмен и теплота
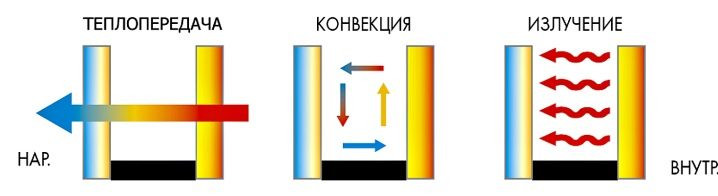
Различают несколько типов теплового обмена:
- Конвекция — процесс теплообмена, характерный для перемешивания газов и жидкостей разной температуры.
- Лучеиспускание — процесс теплообмена за счет тепловых электромагнитных волн.
- Теплопередача — теплообмен между беспорядочно движущимися частицами твердых тел при их контакте.
Теплота может как передаваться системой, так и поглощаться ею. Количество теплоты, переданное или полученное системой в процессе теплового обмена, обозначают \(∆Q\). Условно считается, что положительное значение \(∆Q\) обозначает, что система поглотила энергию, отрицательно – отдала энергию. На основании данного принципа различают экзотермические и эндотермические химические реакции.
Понятие количества теплоты используется в первом и втором началах термодинамики. Первый закон звучит таким образом: термодинамическая система совершает работу лишь в двух случаях: при помощи внешних источников или внутренней энергии. Математически первый закон записывается так:
\(Q=A+∆U\)Q=A+∆U,
где \(Q\) – количество теплоты, переданное или принятое системой;
\(A\) — работа, которую совершила система;
\(∆U\) — изменение внутренней энергии системы.
Второе начало термодинамики гласит, что энтропия изолированной системы неизменна или увеличивается до установления термодинамического равновесия. Другими словами, этот закон говорит о необратимости макроскопических процессов, что протекают с конечной скоростью. Математически второе начало термодинамики выглядит так:
\(dS={∂Q^*\over T}\geq0,\)
где \(S\) — энтропия;
\(∂Q^*\) — элементарное количество тепла изолированной системы;
\(T\) — абсолютная температура.
Понятия, связанные с процессом теплообмена
При изучении вопросов теплового обмена необходимо знать понятия некоторых величин, что связаны с данным процессом. Это внутренняя энергия системы, температура и теплоемкость.
Внутренней энергией является суммарная энергия беспорядочного движения молекул, взаимодействия их собственной и потенциальной энергии, а также внутримолекулярной энергии молекул системы.
Изменение внутренней энергии вызывается сменой его температуры или агрегатного состояния тела. Бесконечно малое изменение внутренней энергии тела обозначается \(dU\). Принято считать, что при положительном значении \(dU\) внутренняя энергия системы увеличивается, а при отрицательном — уменьшается.
Температурой называется такая физическая величина, которая характеризует термодинамическое равновесие системы. В соответствии с молекулярно-кинетической теорией, температура прямо зависит от кинетической энергии системы. Единицей измерения температуры являются градусы Цельсия или Кельвины. По шкале Цельсия \(t\) и Кельвина \(T\) эти величины связаны следующим равенством:
\(t=T-273,15.\)
Теплоемкостью тела называется такая физическая величина, которая равна количеству теплоты, необходимой передать телу для роста его температуры на 1 Кельвин.
Формула для вычисления теплоемкости выглядит так:
\(C={Q\over ΔT}.\)
где \(C\) – теплоемкость тела, Дж/К.
Таким образом, для расчета количества теплоты применяют формулу:
\(Q=C*ΔT.\)
Удельной теплоемкостью считается теплоемкость 1 кг тела. Рассчитывается по следующей формуле:
\(c={Q\over m*ΔT},\)
где \(c\) – удельная теплоемкость, Дж/К кг;
\(m\) – масса тела, кг.
